
Pour réduire l’anxiété, diminuer l’inconfort et atténuer la douleur des patients, la start-up wallone Oncomfort a mis au point un dispositif médical innovant, simple, efficace et disponible en toute langue et à tout moment : des lunettes à réalité virtuelle. C’est une plaisanterie pensez-vous ?
La réalité virtuelle contre la douleur
Eh bien, pas du tout ! Pendant que les médecins lui délivrent des soins, le patient, muni de lunettes à réalité virtuelle, regarde ailleurs… Le patient réalise des exercices de respiration et visionne des images apaisantes.La charge émotionnelle diminue et le temps de récupération aussi. Il est plus calme et l’absence de mouvement facilite le travail du médecin. (Même le médecin est moins tendu.) Ainsi, à terme, les soins sont plus efficaces et plus facilement supportables.
https://le-quotidien-du-patient.fr/article/2017/11/27/halte-au-stress-decouvrez-les-audiocaments/
Des lunettes qui hypnotisent
En effet, les solutions de cette start-up allient hypnose clinique et réalité virtuelle. "Grâce à ce système, le patient est complètement détourné de la réalité. On lui suggère de se concentrer sur la respiration et sur lui-même. On va lui donner des outils afin qu'il puisse contrôler son stress. L'objectif est de diminuer son attention sur la douleur et l'intervention", explique Bart Huys, le directeur commercial d'Oncomfort.Si les solutions sont principalement axées sur le cancer, le principe est appliqué à de nombreuses pathologies. Le centre des brûlés à l'hôpital universitaire de Gand les utilisent. Karel Claes, chirurgien plastique, témoigne : "On l'utilise toujours en combinaison. Le patient reçoit d'office une anesthésie et des anti-douleurs. Mais on voit bien que l'on peut diminuer la dose d'anti-douleurs grâce à l'utilisation des lunettes à réalité virtuelle. Du coup, le patient souffre moins de vertiges."
https://le-quotidien-du-patient.fr/article/demain/medecine/maladies-chroniques/2018/04/23/syndrome-intestin-irritable-medecines-alternatives/
Les solutions d'Oncomfort
Et, à l’heure actuelle, 5 modules, créés avec des médecins, des anesthésistes, oncologues et autres spécialistes, sont disponibles :Aqua pour l’auto-gestion de l’anxiété et de la douleur ; Amo pour la gestion du stress lors de procédures invasives courtes ; Kimo pour l’éducation thérapeutique de la chimiothérapie pour les enfants ; Spatio pour la relaxation avant des séances d’IRM ou de radiothérapie ;
 Spacio, d'OnComfort
Spacio, d'OnComfort
 Spacio2, d'OnComfort
Spacio2, d'OnComfort
 Spacio3, d'OnComfort
Spacio3, d'OnComfort
Stella pour la relaxation lors de procédures pédiatriques courtes.
Durant la grossesse, le fœtus serait (déjà) en contact avec des bactéries placentaires. Ces bactéries contribueraient à l’établissement du microbiote du nouveau-né avant même l’accouchement et la rencontre avec le microbiote vaginal, fécal et cutané de la mère ! Le microbiote du nouveau-né ne sera pas sans conséquence sur les futures pathologies de l'enfant et de l'adulte.
Le microbiote du nouveau-né
Depuis une quarantaine d’années, une théorie propose que l’origine de certaines pathologies pourrait être liée aux phases de développement de l’individu.C’est le concept de l’origine développementale de la santé et des maladies, connue sous l’acronyme DOHaD (developmental origin of health and diseases). Par conséquent, une anomalie dans le développement de la flore intestinale du nouveau-né pourrait être prédictive de certaines pathologies futures.
L'origine du microbiote du nouveau-né
De récents travaux tendent à prouver que le fœtus serait (déjà) en contact avec des bactéries placentaires. Le fœtus n'évoluait donc pas dans un milieu totalement stérile in utero... Ces bactéries contribueraient à l’établissement du microbiote du nouveau-né avant même l’accouchement et la rencontre avec le microbiote vaginal, fécal et cutané de la mère !En effet, lors de l’accouchement, le nouveau-né se retrouve brutalement en contact avec un milieu très dense en bactéries. La "colonisation" du bébé expose celui-ci, très rapidement, à des bactéries d’origine fécale (entérobactéries et bifidobactéries) et à des bactéries de moindre importance d’origine vaginale (lactobacilles).
Premières bactéries implantées, les entérobactéries (principalement l'espèce E. coli), les entérocoques et les staphylocoques sont des organismes aérobies-anaérobies facultatifs. Cependant, du fait de leur consommation d’oxygène, ces bactéries permettent alors l'implantation de bactéries de genre anaérobie strict (Bifidobacterium, Clostridium, Bacteroides) ainsi que des lactobacilles. Enfin, le milieu extérieur dans lequel le bébé naît ainsi que le contact avec son entourage vont également jouer un rôle essentiel dans le développement de la flore de l’enfant.
En effet, de 0 à 3 ans, le microbiote de l'enfant va évoluer jusqu’à atteindre une composition proche de celle de l’adulte.
https://le-quotidien-du-patient.fr/article/demain/medecine/2018/07/06/tout-savoir-sur-le-microbiote/
Quels facteurs modulent la colonisation du nouveau-né ?
– Le mode d’accouchement
Une césarienne expose le nouveau-né au milieu extérieur et retarde l'exposition aux flores fécale et vaginale de la mère. Les premières bactéries implantées sont toujours des organismes anaérobies facultatifs. La flore anaérobie stricte s'implante beaucoup plus tardivement.– L’environnement
Il semblerait que l’environnement – et plus particulièrement l'application de règles d’hygiène plus stricte – joue un rôle dans la colonisation bactérienne du nouveau-né. En effet, les bifidobactéries colonisent à un plus haut niveau les enfants des pays en voie de développement que ceux des pays développés.– L’alimentation
L’alimentation du nouveau-né joue forcément un rôle important dans le développement de la flore bactérienne. En effet, la flore du nouveau-né allaité est moins diversifiée que celle du nouveau-né nourri au lait artificiel. La colonisation par des bactéries de genre anaérobie strict aura lieu plus tard ou à un niveau plus faible.– Le terme de naissance
Un prématuré aura un retard de colonisation important et une diversification limitée. Rapidement séparés de leur mère et soumis à des soins intensifs (antibiothérapie par exemple), la colonisation se fera principalement par des bactéries aérobies (entérobactéries, entérocoques et staphylocoques).Les pathologies associées à une perturbation du développement de la flore intestinale à la naissance
Si tous les mécanismes ne sont pas encore bien connus, une perturbation dans le développement de la flore intestinale a des répercussions sur le développement de certaines pathologies.https://le-quotidien-du-patient.fr/article/demain/medecine/2018/01/30/le-microbiote/
– Allergie
Des corrélations entre naissance par césarienne ou antibiothérapie néonatale – facteurs reconnus pour altérer significativement l’établissement du microbiote – et augmentation du risque de développement de pathologies telles que l’eczéma, l’allergie, l’asthme ou une MICI ont ainsi été observées. La vancomycine (antibiotique), par exemple, réduit la diversité microbiologique et augmente la sévérité de l’allergie. En revanche, un contact avec une grande diversité de micro-organismes – environnement rural ou présence d’animaux de compagnie par exemple–, semble être un gage de protection vis-à-vis de ces pathologies.L’apparition de la flore intestinale, ainsi que l’ordre d’apparition des espèces bactériennes a un rôle dans le développement du système immunitaire, encore immature de l’enfant. La flore constituerait un des premiers signaux et un stimulus pour la maturation du système immunitaire : activation des lymphocytes T, des lymphocytes T-helper et des régulateurs par exemple. De fait, un déséquilibre dans la population des lymphocytes est associé à un risque allergique. Des enfants allergiques ont une population de Bifidobacterium moins importantes que des enfants ne présentant pas d’allergies. Un retard de développement de Bifidobacterium serait donc associé à un risque plus élevé d’allergies. D’autres bactéries pourraient également être impliquées comme les Bactéroïde dans la maturation d’IgA et d’IgM.
https://le-quotidien-du-patient.fr/article/a-table/bien-manger/bebes/2018/03/09/si-je-diversifie-lalimentation-de-bebe-aura-t-il-moins-de-chance-detre-allergique/
– MICI
Les sujets atteints de la Maladie de Crohn et d'une rectocolite hémorragique sont souvent génétiquement pré-disposés. En effet, l'hyper-activité du système immunitaire intestinal est en partie liée à une stimulation bactérienne intestinale, plaçant le microbiote intestinal au centre de ces maladies. Cependant, l’administration de probiotiques, dès le plus jeune âge, améliore l’immunité chez le sujet atteint de MICI.– Entérocolite
Une maturation retardée de la flore intestinale est associée aux entérocolites ulcéro-nécrosantes du nouveau-né. La colonisation anormale du tube digestif du prématuré est reconnue comme un facteur de risque important dans la genèse de cette pathologie.– Obésité et diabète de type 2
Le développement de la flore microbienne aurait également un impact sur des pathologies métaboliques, comme le diabète et l’obésité. Des souris ayant eu une anomalie de développement de la flore ont un phénotype de type obèse. Celui-ci est maintenu même après l’inoculation de souches de flore de souris ayant un phénotype de type normal. De plus, une étude sur plus de 10 000 enfants montre que l’exposition à un traitement antibiotique dans les 6 premiers mois de la vie entraîne une augmentation de poids significative au 38ème mois de la vie. Les sujets obèses ont clairement une flore digestive modifiée, avec une augmentation des Firmicutes par rapport aux Bacteroides.- Obésité et diabète de type 1
L’exposition à un milieu bactérien normal diminue le risque de diabète de type 1. L’incidence du diabète est affecté par le microbiote ou par l’exposition à des stimuli microbiens (mycobactéries ou autres produits microbiens) chez des souris.Sources
La phagothérapie consiste à utiliser les phages pour traiter les infections bactériennes. Les phages, ou plus exactement les bactériophages, sont des virus capables d’éliminer les bactéries. Explications.
Les phages : un nouvel acteur dans l’équation MICI-microbiote intestinal
Même si on n’en connaît pas encore tous les mécanismes, le microbiote intestinal semble jouer un rôle dans les Maladies Inflammatoires de l’Intestin (MICI). Plusieurs faisceaux de preuves soutiennent cette hypothèse : une diminution de la diversité des bactéries présentes dans l’intestin et une diminution de leur nombre observées chez les patients atteints de maladie de Crohn ou de RCH, la présence plus importante de bactéries favorisant un état d’inflammation et à l’inverse une moindre présence des bactéries anti-inflammatoires…Pour en savoir plus :
https://le-quotidien-du-patient.fr/article/demain/medecine/maladies-chroniques/2018/07/24/microbiote-intestinal-et-mici/
Pour remédier à cet état de dysbiose, plusieurs options thérapeutiques peuvent être envisagées :
- La prise d’antibiotique, qui va détruire la flore bactérienne, de manière générale ou au contraire ciblée en fonction de l’antibiotique choisi ;
- L’apport de probiotiques, qui vont enrichir la flore intestinale de bactéries bénéfiques pour l’organisme ;
- La consommation de prébiotiques, qui servent de substrat (nourriture) aux bactéries intestinales et favorisent leur développement ;
- La transplantation fécale, encore à l’étude dans les situations de MICI, pour remplacer le microbiote intestinal du patient par le microbiote d’un sujet sain.
Pour en savoir plus :
https://le-quotidien-du-patient.fr/article/demain/medecine/maladies-chroniques/2017/10/24/transplantationdemicrobiotefecal/
Un nouvel axe thérapeutique : les phages.
Les phages, ou plus exactement les bactériophages, sont des virus capables d’éliminer les bactéries. Ils agissent de manière ciblée en identifiant leurs bactéries cibles, en les infectant puis en provoquant leur destruction. Les virus et les bactériophages sont des éléments naturellement présents dans notre microbiote intestinal. Les phages y jouent notamment un rôle de régulateur en contrôlant la prolifération des populations bactériennes présentes.Pour en savoir plus :
https://le-quotidien-du-patient.fr/article/demain/medecine/2018/07/06/tout-savoir-sur-le-microbiote/
La phagothérapie consiste donc à utiliser les phages pour traiter les infections bactériennes : les bactériophages sont sélectionnés selon la bactérie ou la famille de bactéries ciblée, puis administrés aux patients. En synergie avec le système immunitaire, les virus vont alors attaquer les bactéries impliquées dans la pathologie.
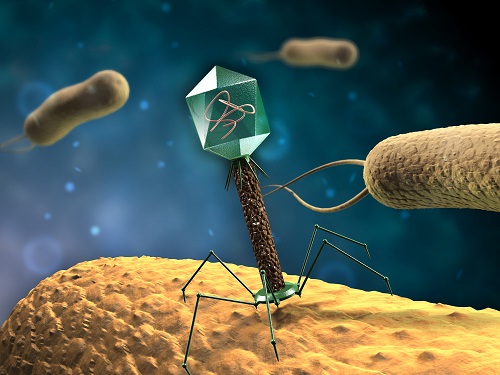 Attaque de bactéries par un bactériophage
Attaque de bactéries par un bactériophage
Les débuts de la recherche…
L’utilisation des virus pour traiter certaines maladies est déjà de l’histoire ancienne, un peu tombée dans les oubliettes avec la découverte des antibiotiques.Les chercheurs et les industriels se penchent à nouveau sur le sujet et étudient l’intérêt des phages comme agents thérapeutiques dans diverses situations pathologiques dont les MICI. Récemment, un consortium public/privé a étudié l’intérêt d’un mélange de phages pour détruire des bactéries pro-inflammatoires couramment observées chez les patients atteints de MICI. Des résultats très encourageants ont été notés sur des modèles animaux et des échantillons de tissus humains. Une étude a également été menée aux USA chez des patients souffrant de troubles gastro-intestinaux dans le but de vérifier si un mélange de phages pouvaient améliorer leur microbiote intestinal. Les données sont en cours d’analyse.
En parallèle de la recherche scientifique, les industriels et les autorités travaillent ensemble pour définir le statut des bactériophages. Actuellement, les connaissances sur ces micro-organismes ne sont pas suffisantes pour pouvoir les faire rentrer dans le champ réglementaire des médicaments et les faire rentrer dans le circuit traditionnel d’évaluation et demande de mise sur le marché. Leur usage reste donc limité au niveau expérimental. Pour le moment…
Sources
Maladie de Crohn, des résultats prometteurs avec un cocktail de phages Bactériophages, les nouveaux probitiqueshttps://presse.inserm.fr/phagotherapie-la-necessaire-cooperation-entre-bacteriophage-et-systeme-immunitaire/28979/
La viande, on l'aime. On partage une bonne côte de bœuf au restaurant, on organise une fondue bourguignonne à la maison et on ne manquerait pour rien au monde le barbecue du dimanche chez les beaux-parents. La viande, l'un des aliments préférés des Français ? Paradoxalement, la consommation de viande diminue depuis plusieurs années et les consommateurs commencent à réfléchir à la qualité de ce qui se trouve dans leur assiette.
5 chiffres qui dérangent
1 - 317 000 000 000 de kilos
Ce chiffre vous a donné mal à la tête ? Nous aussi ! 317 milliards de kilos, c'est pourtant la production mondiale de viande en 2016, soit le poids de plus de 566 000 Airbus A380 (avec passagers) !2 - 86,3 kilos
C'est la quantité de viande consommée en moyenne par un Français en 2014. Ce n'est pas pour vous faire peur, mais un Français pèse en moyenne 79 kilos. Vous mangez donc un homme chaque année. À titre de comparaison, en 1900, cette consommation était « seulement » de 40 kg par an et par habitant.3 - 14,5 %
C'est la part des gaz à effet de serre émis par l'élevage, part supérieure au secteur des transports. Un tour du périphérique en voiture serait donc moins nocif pour l'environnement qu'une côte de bœuf.4 - 4300 g de CO2
C'est l'empreinte carbone de 150 g de bœuf, alors que celle de 150 grammes de carottes est de 45 g de CO2. Verdict : la carotte, on la croque !5 - 22 %
C'est la part de viande produite et commercialisée en Europe qui est finalement perdue ou gaspillée. Imaginez donc que pour 5 steaks achetés chaque semaine, vous en jetez un. 52 steaks jetés annuellement à 15 € le kilo, ça fait réfléchir, non ?
Ces chiffres astronomiques mais pourtant réels semblent avoir éveillé les consciences. Depuis les années 90 en effet, la consommation de viande en France a globalement diminué.
Pourquoi mange-t-on moins de viande ?
1 - Le prix
Le porte-monnaie des Français s'étiole et consommer de la viande au quotidien devient un luxe qui n'est plus à la portée de tout le monde. Au niveau global, les volumes de viandes achetés ont reculé de 3 % en 10 ans alors que les sommes dépensées ont augmenté de 17 %, du fait d’une élévation du prix moyen de 21 %, soit environ 1,70 euro en plus par kilo de produit fini.2 - Une sensibilité accrue à l'environnement
L'Homme semble prendre progressivement conscience de son impact sur la planète. Les scandales alimentaires se multiplient, les vidéos filmées dans les abattoirs heurtent les sensibilités et l'élevage de masse fait réfléchir. La viande n'est nullement supprimée des assiettes mais sa quantité est cependant amoindrie.3 - La santé
En 2015, un rapport de l'OMS a souligné une corrélation entre une consommation abusive de viande rouge et certains cancers. Ce rapport, très largement diffusé, a probablement incité le consommateur à prendre conscience de l'impact de son alimentation sur sa santé. Forcément, entre un steak et une bonne santé, le choix est fait !Manger moins (et mieux) de viande, la solution ?

Nous avons découvert le petit bijou de Gilles Daveau, Manger moins (et mieux) de viande, coédité par Actes Sud et Kaizen, aux collections « Je passe à l'acte ». Un ouvrage concis et limpide dont nous avons tiré quelques enseignements.
Les 5 conseils à suivre pour une consommation de viande raisonnée
1 - Adapter un plat du quotidien en y ajoutant un légume doux ou un féculent, tout en diminuant légèrement la part de viande et en la préférant de meilleure qualité.2 - Faire la part belle aux légumineuses. Car elles constituent un formidable atout au service de la protection du climat et l'une des conditions de la suffisance alimentaire mondiale de ce siècle.
https://le-quotidien-du-patient.fr/article/a-table/bien-manger/aliments/2018/06/19/la-faim-des-haricots-2016-annee-internationale-des-legumineuses/
3 - Favoriser les marques et labels. Chaque marque veille à mettre en avant des critères spécifiques comme l'origine ou la sélection des espèces. Dirigez-vous vers « Label rouge » ou « Agriculture biologique » qui sont les deux seuls labels officiels garantissant l'ensemble du mode de production.
4 - Le poisson, une option ? Il constitue certes une alternative, mais l'ANSES recommande de limiter sa consommation à deux fois par semaine, en raison de ses teneurs en PCB et métaux lourds.
5 - À rythme trop chargé, alimentation trop peu équilibrée. Notre quotidien impliquerait trop de plats préparés, de sandwichs et de repas au restaurant le midi. Et la viande est omniprésente. Vous avez prévu une bonne ratatouille accompagnée de riz ce soir ? Doublez les doses, vous en aurez pour votre pause déj' de demain midi !
Et pour terminer, laissez place à l'imagination et à la créativité. Il ne s'agit pas de renoncer à la viande, mais d'apprendre à la consommer différemment, et avec modération.
https://le-quotidien-du-patient.fr/special/2018/09/27/comment-faire-manger-quatre-fois-moins-de-viande-a-tous-les-bons-vivants/
Contenu relu et validé par une diététicienne WeCook.
Sources
- Organisation des Nations Unies pour l'alimentation et l'agriculture - Bon pour le climat - GIEC, 5e rapport sur les changements climatiques et leurs évolutions futures, 2015 - FranceAgrimer - Organisation Mondiale de la Santé - ANSESPage 90 sur 214
